- ORGANOMÉTALLIQUES (COMPOSÉS)
- ORGANOMÉTALLIQUES (COMPOSÉS)Les organométalliques sont des composés, exclusivement synthétiques, dont la constitution se déduit de celle d’un hydrocarbure en remplaçant un ou plusieurs atomes d’hydrogène par un métal.Cette définition exclut les sels métalliques des acides carboxyliques, les alcoolates, phénates, thiolates, amidures, etc.; on peut l’étendre aux produits de substitution par un métal d’un hydrogène lié au carbone sur un squelette portant, de plus, d’autres fonctions (organométalliques fonctionnels), et à l’association d’un cation métallique à un anion mésomère tel que l’ion céto-énolate.Cet article se limitera à l’étude des organométalliques dérivant d’hydrocarbures; une allusion sera cependant faite aux fonctions qui restent compatibles avec l’existence d’un métal dans la même molécule.On pourrait a priori envisager plusieurs types fondamentaux d’organométalliques: ceux qui résultent de la substitution par un métal d’un seul atome d’hydrogène ou bien du remplacement par plusieurs métaux de plusieurs hydrogènes liés à des carbones différents; ces deux types sont connus, mais on pourrait aussi prévoir le remplacement de plusieurs hydrogènes d’un même carbone par un métal plurivalent. Ce dernier type ne paraît pas avoir été rencontré jusqu’ici.Toutefois, on conçoit déjà une grande variété parmi les dérivés métalliques des premiers types. Si le métal est essentiellement univalent (M1), le dérivé s’écrit RM1. Si le métal est plurivalent (Mn ), on appelle organométalliques symétriques les composés (R)n Mn ; mais, le métal n’échangeant qu’une seule valence avec le radical R, on peut aussi envisager des dérivés métalliques dans lesquels le métal utilise ses autres valences vis-à-vis d’anions minéraux, en général des ions halogénure, soit la série, plus ou moins compliquée selon la valence n :
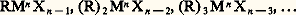 Ces composés portent le nom d’organométalliques mixtes.Les propriétés physiques et chimiques des organométalliques varient avec la nature de R, de X, et surtout avec n et avec la tendance de Mn à donner des covalences.C’est ainsi que les dérivés sodés et potassés (RNa, RK) sont nettement électrovalents et très réactifs (R-, Na+; R-, K+), que les métaux nettement covalents, l’étain par exemple, engendrent la série complète des composés moléculaires:
Ces composés portent le nom d’organométalliques mixtes.Les propriétés physiques et chimiques des organométalliques varient avec la nature de R, de X, et surtout avec n et avec la tendance de Mn à donner des covalences.C’est ainsi que les dérivés sodés et potassés (RNa, RK) sont nettement électrovalents et très réactifs (R-, Na+; R-, K+), que les métaux nettement covalents, l’étain par exemple, engendrent la série complète des composés moléculaires: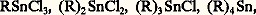 et que ces derniers sont relativement peu réactifs.Malheureusement, le métal qui joue le plus grand rôle dans le domaine des organométalliques, le magnésium, conduit à des résultats si complexes que des doutes sérieux demeurent sur la constitution de ses dérivés. Les organomagnésiens symétriques (R)2Mg non solvatés sont nettement électrovalents et sont assez comparables aux dérivés sodés, mais, solvatés par un éther-oxyde, ils deviennent nettement covalents, bien qu’il soit difficile en général de les extraire sous cette forme de leur solution dans un excès de solvant. La question des organomagnésiens mixtes est encore très controversée. S’il a été possible d’isoler à l’état cristallisé le composé C2H5MgBr,2((C2H5)2O), il n’est nullement démontré que cette entité constitue la majeure partie de ce qu’on appelle le réactif de Grignard; divers auteurs ont proposé d’envisager d’autres complexes dans ce réactif.Électrovalents à l’état non solvaté, les dérivés lithiens semblent pouvoir s’associer à des solvants qui les dissolvent. Les organoaluminiques, les organocadmiens ont pu être isolés sous les formes symétriques et mixtes non solvatées; ils sont, à cet état, encore nettement covalents; cependant ils se solvatent, par exemple dans l’oxyde d’éthyle, et les mêmes doutes subsistent sur ces solutions que sur le réactif de Grignard.1. Genèse des dérivés métalliquesLes organométalliques résultent en général de l’une des cinq réactions ci-dessous:1. Réduction d’un dérivé halogéné par un métal, qui s’écrit schématiquement des deux manières suivantes:
et que ces derniers sont relativement peu réactifs.Malheureusement, le métal qui joue le plus grand rôle dans le domaine des organométalliques, le magnésium, conduit à des résultats si complexes que des doutes sérieux demeurent sur la constitution de ses dérivés. Les organomagnésiens symétriques (R)2Mg non solvatés sont nettement électrovalents et sont assez comparables aux dérivés sodés, mais, solvatés par un éther-oxyde, ils deviennent nettement covalents, bien qu’il soit difficile en général de les extraire sous cette forme de leur solution dans un excès de solvant. La question des organomagnésiens mixtes est encore très controversée. S’il a été possible d’isoler à l’état cristallisé le composé C2H5MgBr,2((C2H5)2O), il n’est nullement démontré que cette entité constitue la majeure partie de ce qu’on appelle le réactif de Grignard; divers auteurs ont proposé d’envisager d’autres complexes dans ce réactif.Électrovalents à l’état non solvaté, les dérivés lithiens semblent pouvoir s’associer à des solvants qui les dissolvent. Les organoaluminiques, les organocadmiens ont pu être isolés sous les formes symétriques et mixtes non solvatées; ils sont, à cet état, encore nettement covalents; cependant ils se solvatent, par exemple dans l’oxyde d’éthyle, et les mêmes doutes subsistent sur ces solutions que sur le réactif de Grignard.1. Genèse des dérivés métalliquesLes organométalliques résultent en général de l’une des cinq réactions ci-dessous:1. Réduction d’un dérivé halogéné par un métal, qui s’écrit schématiquement des deux manières suivantes: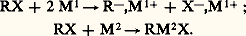 2. Action d’un hydrocarbure assez «acide» sur l’organométallique d’un hydrocarbure moins acide:
2. Action d’un hydrocarbure assez «acide» sur l’organométallique d’un hydrocarbure moins acide: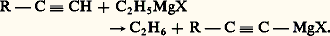 3. Échange fonctionnel entre un dérivé halogéné et un organométallique:
3. Échange fonctionnel entre un dérivé halogéné et un organométallique: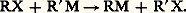 4. Action d’un halogénure métallique sur le dérivé d’un autre métal:
4. Action d’un halogénure métallique sur le dérivé d’un autre métal: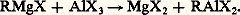 5. Action d’un métal sur un autre organométallique:
5. Action d’un métal sur un autre organométallique: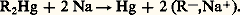 Si l’hydrocarbure dont dérive l’organométallique est assez acide, on peut remplacer, dans la deuxième réaction, l’organométallique auxiliaire par le dérivé métallique d’un hydrure peu acide:
Si l’hydrocarbure dont dérive l’organométallique est assez acide, on peut remplacer, dans la deuxième réaction, l’organométallique auxiliaire par le dérivé métallique d’un hydrure peu acide: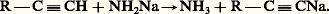 La première réaction est, de beaucoup, la plus importante; son mécanisme n’est pas encore parfaitement élucidé. Il est probable que la réduction de RX en RM s’opère en deux phases:
La première réaction est, de beaucoup, la plus importante; son mécanisme n’est pas encore parfaitement élucidé. Il est probable que la réduction de RX en RM s’opère en deux phases: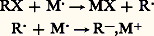 ou bien:
ou bien: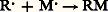 La seconde phase serait concurrencée par deux autres évolutions de R.: la réaction de Wurtz (2 R.R 漣 R) et la dismutation (2 R.R (+ H) + R (face=F0019 漣 H)).Enfin, dans les conditions où il prend naissance, l’organométallique peut réagir sur l’halogénure en excès:
La seconde phase serait concurrencée par deux autres évolutions de R.: la réaction de Wurtz (2 R.R 漣 R) et la dismutation (2 R.R (+ H) + R (face=F0019 漣 H)).Enfin, dans les conditions où il prend naissance, l’organométallique peut réagir sur l’halogénure en excès: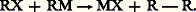 La première phase est celle qui exige le moindre transfert électronique entre le métal et l’halogénure; on la dépasse difficilement si l’halogénure est peu actif et le métal peu électropositif. Mais, dans le cas extrême contraire, la troisième réaction est presque inévitable. La nucléophilie du solvant provoque une évolution dans le même sens que la fragilité de l’halogénure et que l’électropositivité du métal.Un bon rendement en organométallique RM exige donc un compromis entre le métal, l’halogène et le solvant.De fait, le sodium agit, sans solvant (ou dans des solvants inertes), sur la plupart des dérivés halogénés, mais, la troisième phase ne pouvant être évitée, la réaction de Wurtz résulte à la fois de la duplication concurrentielle du radical et de la troisième réaction. On n’obtient pas alors le dérivé sodé. L’action du lithium ne conduit guère au dérivé lithien que si l’halogène est le chlore; avec des dérivés bromés ou iodés, on n’assiste généralement qu’à la duplication.Le magnésium n’attaque les dérivés halogénés qu’en présence de solvants nucléophiles, mais l’éther l’est insuffisamment pour provoquer l’attaque des halogéno-éthyléniques; il faut alors faire appel à un solvant plus nucléophile, le tétrahydrofuranne. Par contre, l’halogène des halogéno-éthyléniques étant peu mobile, la troisième réaction n’est pas à craindre.Enfin, le bromure d’allyle possède un halogène très mobile; si on l’attaque par le magnésium dans l’éther, la troisième réaction n’a qu’une importance modérée, mais, dans le tétrahydrofuranne, elle provoque la disparition complète de l’organométallique.2. OrganomagnésiensLe réactif de GrignardV. Grignard constata vers 1900 qu’une solution de bromure d’éthyle dans l’éther anhydre dissout des copeaux de magnésium de pureté suffisante par une réaction exothermique qui porte le solvant à une vive ébullition.Le grand mérite de ce savant fut d’utiliser la solution ainsi préparée pour des synthèses sans chercher à en isoler les constituants. Cette découverte devait, dans les années qui suivirent, et encore aujourd’hui, fournir à la synthèse, tout au moins à l’échelle du laboratoire, l’un de ses plus précieux réactifs.La réaction de Grignard a pu être étendue à d’autres dérivés halogénés: éthers chlorhydriques, bromhydriques, iodhydriques, bromure et iodure de phényle. Ce n’est que beaucoup plus tard qu’elle a pu être appliquée par l’emploi de solvants plus nucléophiles que l’éther (tétrahydrofuranne) aux halogéno-éthyléniques, aux halogéno-acétyléniques, au chlorure de phényle.– La réaction de Grignard s’écrit schématiquement:
La première phase est celle qui exige le moindre transfert électronique entre le métal et l’halogénure; on la dépasse difficilement si l’halogénure est peu actif et le métal peu électropositif. Mais, dans le cas extrême contraire, la troisième réaction est presque inévitable. La nucléophilie du solvant provoque une évolution dans le même sens que la fragilité de l’halogénure et que l’électropositivité du métal.Un bon rendement en organométallique RM exige donc un compromis entre le métal, l’halogène et le solvant.De fait, le sodium agit, sans solvant (ou dans des solvants inertes), sur la plupart des dérivés halogénés, mais, la troisième phase ne pouvant être évitée, la réaction de Wurtz résulte à la fois de la duplication concurrentielle du radical et de la troisième réaction. On n’obtient pas alors le dérivé sodé. L’action du lithium ne conduit guère au dérivé lithien que si l’halogène est le chlore; avec des dérivés bromés ou iodés, on n’assiste généralement qu’à la duplication.Le magnésium n’attaque les dérivés halogénés qu’en présence de solvants nucléophiles, mais l’éther l’est insuffisamment pour provoquer l’attaque des halogéno-éthyléniques; il faut alors faire appel à un solvant plus nucléophile, le tétrahydrofuranne. Par contre, l’halogène des halogéno-éthyléniques étant peu mobile, la troisième réaction n’est pas à craindre.Enfin, le bromure d’allyle possède un halogène très mobile; si on l’attaque par le magnésium dans l’éther, la troisième réaction n’a qu’une importance modérée, mais, dans le tétrahydrofuranne, elle provoque la disparition complète de l’organométallique.2. OrganomagnésiensLe réactif de GrignardV. Grignard constata vers 1900 qu’une solution de bromure d’éthyle dans l’éther anhydre dissout des copeaux de magnésium de pureté suffisante par une réaction exothermique qui porte le solvant à une vive ébullition.Le grand mérite de ce savant fut d’utiliser la solution ainsi préparée pour des synthèses sans chercher à en isoler les constituants. Cette découverte devait, dans les années qui suivirent, et encore aujourd’hui, fournir à la synthèse, tout au moins à l’échelle du laboratoire, l’un de ses plus précieux réactifs.La réaction de Grignard a pu être étendue à d’autres dérivés halogénés: éthers chlorhydriques, bromhydriques, iodhydriques, bromure et iodure de phényle. Ce n’est que beaucoup plus tard qu’elle a pu être appliquée par l’emploi de solvants plus nucléophiles que l’éther (tétrahydrofuranne) aux halogéno-éthyléniques, aux halogéno-acétyléniques, au chlorure de phényle.– La réaction de Grignard s’écrit schématiquement: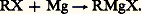 Ce n’est toutefois que l’expression globale d’une transformation, qui d’ailleurs n’est pas quantitative; elle est plus ou moins accompagnée, comme il a été vu plus haut, de duplication ou de dismutation du radical R; si R est saturé, le rendement augmente, des iodures aux bromures, puis aux chlorures, mais la facilité de l’attaque du métal varie en sens inverse. Les fluorures sont inactifs. En revanche, le rendement est meilleur avec les éthers halohydriques primaires qu’avec les secondaires ou les tertiaires, et, dans le cas des halogénures 見-éthyléniques, ce n’est qu’au prix de sévères précautions qu’on évite en partie des duplications.De nombreuses hypothèses se sont succédé en ce qui concerne la nature des entités présentes dans le réactif de Grignard. L’une des plus généralement admises est l’existence d’un complexe solvaté (formule 1).De fait, ce complexe a pu être isolé à l’état cristallisé, et l’analyse aux rayons X a confirmé la structure supposée. Mais des doutes subsistent sur la réalité de l’«équilibre de Schlenck » (réaction 2).En effet, l’addition, au réactif de Grignard, d’une quantité suffisante de dioxanne provoque la précipitation de tous les halogènes de la solution sous forme de MgBr2 solvaté, et le liquide surnageant semble constitué du magnésien symétrique solvaté (R)2Mg, solvant.L’évaporation laisse un résidu de ce solvat qui, sous vide poussé, abandonne son solvant et laisse subsister le magnésien symétrique (R)2Mg, poudre microcristalline spontanément inflammable et pratiquement inutilisable en synthèse.Cependant, la nature des entités présentes dans le réactif de Grignard semble dépendre à la fois de celle de R, de celle du solvant et de celle de l’halogène, et aucune structure générale n’a pu s’imposer jusqu’ici.Le comportement du réactif de Grignard est parfois le même que celui du magnésien symétrique solvaté, mais parfois il en diffère quantitativement et même qualitativement. C’est la raison pour laquelle les réactions qui vont être décrites sont celles que l’on observe avec les réactifs de Grignard bruts de fabrication, c’est-à-dire représentés globalement par la formule RMgBr, bien que les réactions accessoires laissent présumer que la teneur en halogénure de magnésium du milieu est toujours supérieure à la teneur indiquée par cette formule, et que cet excès de MgX2 modifie quelque peu les réactions observées avec un magnésien mixte «synthétique», c’est-à-dire résultant de l’addition stœchiométrique à (R)2Mg de MgX2, et d’un excès de solvant.Les réactions de la solution de Grignard peuvent être classées en quatre groupes: action des composés à hydrogène mobile, action des composés à halogène mobile (ou à autre anion mobile), réactions d’addition, réactions utilisant plusieurs molécules d’organomagnésien mixte.Schématiquement, tout se passe comme si l’halogénomagnésien mixte se dissociait ainsi:
Ce n’est toutefois que l’expression globale d’une transformation, qui d’ailleurs n’est pas quantitative; elle est plus ou moins accompagnée, comme il a été vu plus haut, de duplication ou de dismutation du radical R; si R est saturé, le rendement augmente, des iodures aux bromures, puis aux chlorures, mais la facilité de l’attaque du métal varie en sens inverse. Les fluorures sont inactifs. En revanche, le rendement est meilleur avec les éthers halohydriques primaires qu’avec les secondaires ou les tertiaires, et, dans le cas des halogénures 見-éthyléniques, ce n’est qu’au prix de sévères précautions qu’on évite en partie des duplications.De nombreuses hypothèses se sont succédé en ce qui concerne la nature des entités présentes dans le réactif de Grignard. L’une des plus généralement admises est l’existence d’un complexe solvaté (formule 1).De fait, ce complexe a pu être isolé à l’état cristallisé, et l’analyse aux rayons X a confirmé la structure supposée. Mais des doutes subsistent sur la réalité de l’«équilibre de Schlenck » (réaction 2).En effet, l’addition, au réactif de Grignard, d’une quantité suffisante de dioxanne provoque la précipitation de tous les halogènes de la solution sous forme de MgBr2 solvaté, et le liquide surnageant semble constitué du magnésien symétrique solvaté (R)2Mg, solvant.L’évaporation laisse un résidu de ce solvat qui, sous vide poussé, abandonne son solvant et laisse subsister le magnésien symétrique (R)2Mg, poudre microcristalline spontanément inflammable et pratiquement inutilisable en synthèse.Cependant, la nature des entités présentes dans le réactif de Grignard semble dépendre à la fois de celle de R, de celle du solvant et de celle de l’halogène, et aucune structure générale n’a pu s’imposer jusqu’ici.Le comportement du réactif de Grignard est parfois le même que celui du magnésien symétrique solvaté, mais parfois il en diffère quantitativement et même qualitativement. C’est la raison pour laquelle les réactions qui vont être décrites sont celles que l’on observe avec les réactifs de Grignard bruts de fabrication, c’est-à-dire représentés globalement par la formule RMgBr, bien que les réactions accessoires laissent présumer que la teneur en halogénure de magnésium du milieu est toujours supérieure à la teneur indiquée par cette formule, et que cet excès de MgX2 modifie quelque peu les réactions observées avec un magnésien mixte «synthétique», c’est-à-dire résultant de l’addition stœchiométrique à (R)2Mg de MgX2, et d’un excès de solvant.Les réactions de la solution de Grignard peuvent être classées en quatre groupes: action des composés à hydrogène mobile, action des composés à halogène mobile (ou à autre anion mobile), réactions d’addition, réactions utilisant plusieurs molécules d’organomagnésien mixte.Schématiquement, tout se passe comme si l’halogénomagnésien mixte se dissociait ainsi: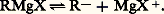 Mais le solvant donne à la liaison R 漣 Mg un caractère covalent suffisant pour différencier les magnésiens mixtes des dérivés sodés pour lesquels la dissociation totale:
Mais le solvant donne à la liaison R 漣 Mg un caractère covalent suffisant pour différencier les magnésiens mixtes des dérivés sodés pour lesquels la dissociation totale: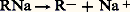 est admise. Aussi, les organomagnésiens mixtes ne donnent-ils lieu qu’à des réactions entre dipôles, c’est-à-dire ne rentrant qu’exceptionnellement dans le cadre des processus classiques et s’apparentant plus fréquemment aux mésomécanismes.Réaction des composés à hydrogène mobileEn principe, tous les composés dont le pKa est inférieur à 25 décomposent quantitativement les organomagnésiens:
est admise. Aussi, les organomagnésiens mixtes ne donnent-ils lieu qu’à des réactions entre dipôles, c’est-à-dire ne rentrant qu’exceptionnellement dans le cadre des processus classiques et s’apparentant plus fréquemment aux mésomécanismes.Réaction des composés à hydrogène mobileEn principe, tous les composés dont le pKa est inférieur à 25 décomposent quantitativement les organomagnésiens: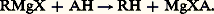 Cette échelle d’acidité suffisante s’étend des acides forts aux hydrocarbures acétyléniques vrais en passant par les acides faibles, les phénols, l’eau, les alcools, les amines non tertiaires. La nature de MgXA dépend de celle de A; MgXA peut se comporter comme un sel métallique si A est un halogène, ou comme un complexe solvaté lorsque A = OR; l’alcoolate magnésien mixte ROMgX est solvaté.Dans le cas de l’eau, tout se passe comme si 2 MgXOH se décomposait en MgX2 + Mg(OH)2. Dans celui des carbures acétyléniques vrais, le dérivé R 漣 C 令 C 漣 MgX, solvaté, est un nouvel organométallique.Seule cette dernière réaction présente un intérêt en synthèse; les autres ne constituent qu’une préparation de l’hydrocarbure RH à partir de RMgX, donc, initialement, de RX (ou de ROH). Bien entendu, l’eau est le réactif le plus indiqué pour réaliser cette protolyse, mais, afin d’éviter un empâtement du milieu par la magnésie précipitée, il est plus intéressant de faire appel à une solution acide diluée qui solubilise cette magnésie et rend l’extraction de l’hydrocarbure plus aisée; c’est évidemment inutile si cet hydrocarbure est plus volatil que l’éther (préparation du méthane ou de l’éthane), mais il convient de débarrasser le gaz de l’éther entraîné, par barbotage dans l’acide sulfurique, ou de substituer à l’éther un éther-oxyde moins volatil (oxyde de butyle). Le même changement de solvant s’impose si l’hydrocarbure cherché a une volatilité voisine de celle de l’éther.Réactions de composés à anion mobileHalogènes et dérivés halogénésLes halogènes agissent principalement dans le sens:
Cette échelle d’acidité suffisante s’étend des acides forts aux hydrocarbures acétyléniques vrais en passant par les acides faibles, les phénols, l’eau, les alcools, les amines non tertiaires. La nature de MgXA dépend de celle de A; MgXA peut se comporter comme un sel métallique si A est un halogène, ou comme un complexe solvaté lorsque A = OR; l’alcoolate magnésien mixte ROMgX est solvaté.Dans le cas de l’eau, tout se passe comme si 2 MgXOH se décomposait en MgX2 + Mg(OH)2. Dans celui des carbures acétyléniques vrais, le dérivé R 漣 C 令 C 漣 MgX, solvaté, est un nouvel organométallique.Seule cette dernière réaction présente un intérêt en synthèse; les autres ne constituent qu’une préparation de l’hydrocarbure RH à partir de RMgX, donc, initialement, de RX (ou de ROH). Bien entendu, l’eau est le réactif le plus indiqué pour réaliser cette protolyse, mais, afin d’éviter un empâtement du milieu par la magnésie précipitée, il est plus intéressant de faire appel à une solution acide diluée qui solubilise cette magnésie et rend l’extraction de l’hydrocarbure plus aisée; c’est évidemment inutile si cet hydrocarbure est plus volatil que l’éther (préparation du méthane ou de l’éthane), mais il convient de débarrasser le gaz de l’éther entraîné, par barbotage dans l’acide sulfurique, ou de substituer à l’éther un éther-oxyde moins volatil (oxyde de butyle). Le même changement de solvant s’impose si l’hydrocarbure cherché a une volatilité voisine de celle de l’éther.Réactions de composés à anion mobileHalogènes et dérivés halogénésLes halogènes agissent principalement dans le sens: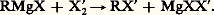 Cette réaction permet, par exemple, de passer de RBr à RI; elle est employée pour le dosage de l’organomagnésien (cf. infra ).Les halogénures métalloïdiques, apparentés aux halogénures d’acide, les halogénures des métaux de transition plurivalents décomposent les organomagnésiens; voici quelques exemples:
Cette réaction permet, par exemple, de passer de RBr à RI; elle est employée pour le dosage de l’organomagnésien (cf. infra ).Les halogénures métalloïdiques, apparentés aux halogénures d’acide, les halogénures des métaux de transition plurivalents décomposent les organomagnésiens; voici quelques exemples: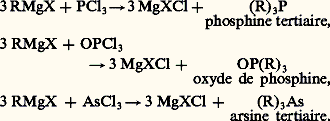 Le produit obtenu n’étant pas solvaté, le résultat est simple. Il se complique dans le cas des halogénures de métaux lourds: SnCl4, selon les proportions, conduit à RSnCl3, à (R)2SnCl2, à (R)3SnCl et à Sn(R)4; HgCl2 conduit à RHgCl ou à (R)2Hg.Les choses se compliquent encore si le produit résultant est solvaté. La même ambiguïté se présente pour la composition du liquide obtenu que pour le réactif de Grignard: il est en effet difficile de savoir si AlCl3 conduit à RAlCl2, à (R)2AlCl et à (R)3Al solvatés ou à leur mélange en équilibre; il en est de même pour ZnCl2 ou CdCl2.Parmi les dérivés halogénés organiques, seuls les chlorures d’acides agissent régulièrement (cf. infra ).Les halogéno-éthyléniques, les halogénures phényliques et la plupart des éthers halohydriques non tertiaires sont sans action en l’absence de catalyseurs. Mais, sous l’action du chlorure de cobalt anhydre, on observe une réaction radicalaire se traduisant par une soudure ou, plus souvent, par une dismutation (réaction 3).Par contre, les halogénures 見-non saturés donnent lieu, sans catalyseur, à une condensation (réaction 4).Avec les homologues, on observe une transposition partielle qui est prépondérante avec les halogénures propargyliques (réaction 5).Les iodures et bromures tertiaires agissent facilement (réaction 6). Plus réactifs, les éthers sulfuriques, même primaires, conduisent à une condensation analogue.Enfin, l’éther chlorométhylique se condense sans catalyseur.Groupes OR et éthers minérauxLe groupe éthoxyle est bien moins actif que le groupe halogénure. Les éthers oxydes et les acétals n’agissent qu’exceptionnellement; au contraire, les ortho-éthers et l’éther orthocarbonique conduisent à des acétals (réaction 7) ou à des cétals.Les esters agissent comme les chlorures d’acides.Réactions d’additionL’oxygène s’additionne aux organomagnésiens :
Le produit obtenu n’étant pas solvaté, le résultat est simple. Il se complique dans le cas des halogénures de métaux lourds: SnCl4, selon les proportions, conduit à RSnCl3, à (R)2SnCl2, à (R)3SnCl et à Sn(R)4; HgCl2 conduit à RHgCl ou à (R)2Hg.Les choses se compliquent encore si le produit résultant est solvaté. La même ambiguïté se présente pour la composition du liquide obtenu que pour le réactif de Grignard: il est en effet difficile de savoir si AlCl3 conduit à RAlCl2, à (R)2AlCl et à (R)3Al solvatés ou à leur mélange en équilibre; il en est de même pour ZnCl2 ou CdCl2.Parmi les dérivés halogénés organiques, seuls les chlorures d’acides agissent régulièrement (cf. infra ).Les halogéno-éthyléniques, les halogénures phényliques et la plupart des éthers halohydriques non tertiaires sont sans action en l’absence de catalyseurs. Mais, sous l’action du chlorure de cobalt anhydre, on observe une réaction radicalaire se traduisant par une soudure ou, plus souvent, par une dismutation (réaction 3).Par contre, les halogénures 見-non saturés donnent lieu, sans catalyseur, à une condensation (réaction 4).Avec les homologues, on observe une transposition partielle qui est prépondérante avec les halogénures propargyliques (réaction 5).Les iodures et bromures tertiaires agissent facilement (réaction 6). Plus réactifs, les éthers sulfuriques, même primaires, conduisent à une condensation analogue.Enfin, l’éther chlorométhylique se condense sans catalyseur.Groupes OR et éthers minérauxLe groupe éthoxyle est bien moins actif que le groupe halogénure. Les éthers oxydes et les acétals n’agissent qu’exceptionnellement; au contraire, les ortho-éthers et l’éther orthocarbonique conduisent à des acétals (réaction 7) ou à des cétals.Les esters agissent comme les chlorures d’acides.Réactions d’additionL’oxygène s’additionne aux organomagnésiens :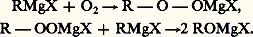 À l’hydrolyse, on recueille l’hydroperoxyde R 漣 OOH (ou C6H5 漣 OOH) ou l’alcool ROH (ou le phénol C6H5 漣 OH).Le soufre se comporte comme l’oxygène.Les réactions les plus intéressantes sont les additions sur une liaison multiple entre carbone et hétéroatome; il faut signaler ici que l’addition sur une liaison multiple carbone-carbone n’est que tout à fait exceptionnelle.Le dioxyde de carbone conduit à un carboxylate magnésien mixte (carbonation):
À l’hydrolyse, on recueille l’hydroperoxyde R 漣 OOH (ou C6H5 漣 OOH) ou l’alcool ROH (ou le phénol C6H5 漣 OH).Le soufre se comporte comme l’oxygène.Les réactions les plus intéressantes sont les additions sur une liaison multiple entre carbone et hétéroatome; il faut signaler ici que l’addition sur une liaison multiple carbone-carbone n’est que tout à fait exceptionnelle.Le dioxyde de carbone conduit à un carboxylate magnésien mixte (carbonation):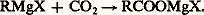 Le carboxylate est détruit par les acides minéraux dilués (synthèse des acides carboxyliques):
Le carboxylate est détruit par les acides minéraux dilués (synthèse des acides carboxyliques):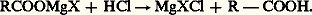 Toutefois, la condensation avec d’autres molécules RMgX peut conduire à des cétones ou à des alcools tertiaires.Les dérivés carbonylés conduisent à des alcoolates et, après hydrolyse, aux alcools:
Toutefois, la condensation avec d’autres molécules RMgX peut conduire à des cétones ou à des alcools tertiaires.Les dérivés carbonylés conduisent à des alcoolates et, après hydrolyse, aux alcools: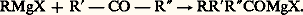 C’est la synthèse la plus générale des alcools, primaires si l’on part de l’aldéhyde formique, secondaires dans le cas de tous les autres aldéhydes, tertiaires dans celui des cétones; cependant, si la cétone est 見-éthylénique, l’addition peut se faire plus ou moins partiellement en -1,4 sur le système conjugué (réaction 8).À l’hydrolyse, on isole l’énol correspondant qui se transforme spontanément en cétone; on assiste donc à une «addition apparente» sur la double liaison éthylénique.De plus, si la cétone est encombrée et si l’organomagnésien porte de l’hydrogène sur le carbone en 見, l’addition est concurrencée par une réduction (réaction 9).À l’hydrolyse, on aboutit alors à un alcool secondaire. Enfin, une partie du magnésien peut énoliser la cétone, et à l’hydrolyse on retrouve une partie de la cétone mise en œuvre.Les nitriles donnent lieu à une addition semblable:
C’est la synthèse la plus générale des alcools, primaires si l’on part de l’aldéhyde formique, secondaires dans le cas de tous les autres aldéhydes, tertiaires dans celui des cétones; cependant, si la cétone est 見-éthylénique, l’addition peut se faire plus ou moins partiellement en -1,4 sur le système conjugué (réaction 8).À l’hydrolyse, on isole l’énol correspondant qui se transforme spontanément en cétone; on assiste donc à une «addition apparente» sur la double liaison éthylénique.De plus, si la cétone est encombrée et si l’organomagnésien porte de l’hydrogène sur le carbone en 見, l’addition est concurrencée par une réduction (réaction 9).À l’hydrolyse, on aboutit alors à un alcool secondaire. Enfin, une partie du magnésien peut énoliser la cétone, et à l’hydrolyse on retrouve une partie de la cétone mise en œuvre.Les nitriles donnent lieu à une addition semblable: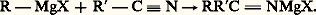 L’hydrolyse se fait en deux phases, conduisant d’abord à l’imine RR C 略 NH, puis à la cétone R 漣 CO 漣 R et à l’ammoniac.Si le nitrile possède un hydrogène acide, cette réaction est éclipsée par celle conduisant à un éniminure qui à l’hydrolyse redonne le nitrile initial: il n’y a plus de synthèse.Les imines stables agissent comme les cétones:
L’hydrolyse se fait en deux phases, conduisant d’abord à l’imine RR C 略 NH, puis à la cétone R 漣 CO 漣 R et à l’ammoniac.Si le nitrile possède un hydrogène acide, cette réaction est éclipsée par celle conduisant à un éniminure qui à l’hydrolyse redonne le nitrile initial: il n’y a plus de synthèse.Les imines stables agissent comme les cétones: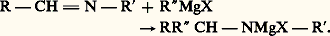 L’hydrolyse conduit à l’amine:
L’hydrolyse conduit à l’amine: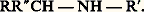 Réactions utilisant plusieurs molécules d’organomagnésienDans une première phase, les chlorures d’acides et les esters forment vraisemblablement un composé d’addition:
Réactions utilisant plusieurs molécules d’organomagnésienDans une première phase, les chlorures d’acides et les esters forment vraisemblablement un composé d’addition: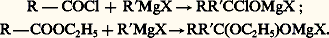 On ne sait si ces complexes se décomposent en cétone R 漣 CO 漣 R et, respectivement, en MgXCl ou en C2H5OMgX. Toutefois, la cétone apparaît après hydrolyse; l’arrêt à ce stade exige une température très basse (face=F0019 漣 80 0C) et l’«addition inverse» (on fait couler l’organométallique dans la solution éthérée du chlorure d’acide ou de l’ester). À la température ordinaire et par addition directe, on aboutit à un alcoolate tertiaire; les esters formiques, toutefois, conduisent à un alcool secondaire.On ignore si cette seconde réaction est due à l’attaque par une seconde molécule de RMgX du complexe d’addition ou de la cétone qui résulte de sa décomposition.Les amides conduisent, en principe, à des cétones, mais, si l’amide n’est pas N-bisubstitué, la réaction consomme en pure perte une partie de l’organométallique, du fait de l’existence d’hydrogènes acides. La réaction n’est pratique que dans le cas du diéthylformamide:
On ne sait si ces complexes se décomposent en cétone R 漣 CO 漣 R et, respectivement, en MgXCl ou en C2H5OMgX. Toutefois, la cétone apparaît après hydrolyse; l’arrêt à ce stade exige une température très basse (face=F0019 漣 80 0C) et l’«addition inverse» (on fait couler l’organométallique dans la solution éthérée du chlorure d’acide ou de l’ester). À la température ordinaire et par addition directe, on aboutit à un alcoolate tertiaire; les esters formiques, toutefois, conduisent à un alcool secondaire.On ignore si cette seconde réaction est due à l’attaque par une seconde molécule de RMgX du complexe d’addition ou de la cétone qui résulte de sa décomposition.Les amides conduisent, en principe, à des cétones, mais, si l’amide n’est pas N-bisubstitué, la réaction consomme en pure perte une partie de l’organométallique, du fait de l’existence d’hydrogènes acides. La réaction n’est pratique que dans le cas du diéthylformamide: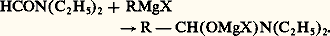 L’hydrolyse libère l’amine (C2H5)2NH et l’aldéhyde R 漣 CHO.Les fonctions quadrivalentes: COCl2, ClCOOC2H5, CO(OC2H5)2, conduisent par des intermédiaires supposés (chlorure d’acide, esters, cétones) à des alcoolates tertaires:
L’hydrolyse libère l’amine (C2H5)2NH et l’aldéhyde R 漣 CHO.Les fonctions quadrivalentes: COCl2, ClCOOC2H5, CO(OC2H5)2, conduisent par des intermédiaires supposés (chlorure d’acide, esters, cétones) à des alcoolates tertaires: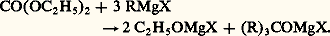 Dosage des organomagnésiensIl est parfois utile de connaître la teneur du réactif de Grignard en organomagnésien, la préparation à partir de RX n’étant pas quantitative.Deux méthodes sont employées:– le dosage alcalimétrique de la magnésie libérée par l’hydrolyse:
Dosage des organomagnésiensIl est parfois utile de connaître la teneur du réactif de Grignard en organomagnésien, la préparation à partir de RX n’étant pas quantitative.Deux méthodes sont employées:– le dosage alcalimétrique de la magnésie libérée par l’hydrolyse: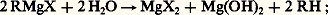 – l’action de l’iode en excès:
– l’action de l’iode en excès: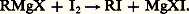 Le thiosulfate dose l’iode non employé.La première méthode est excédentaire, car elle dose comme organométalliques les produits d’une hydrolyse ou d’une oxydation accidentelle; la seconde est déficitaire, car la réaction parasite:
Le thiosulfate dose l’iode non employé.La première méthode est excédentaire, car elle dose comme organométalliques les produits d’une hydrolyse ou d’une oxydation accidentelle; la seconde est déficitaire, car la réaction parasite: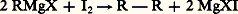 utilise moins d’iode que la précédente. Si les deux dosages sont peu différents, leur moyenne donne une valeur approximative de la teneur en organométalliques.3. Autres organométalliquesOrgano-alcalinsLes dérivés sodés se préparent généralement par action du sodium sur les organomercuriques:
utilise moins d’iode que la précédente. Si les deux dosages sont peu différents, leur moyenne donne une valeur approximative de la teneur en organométalliques.3. Autres organométalliquesOrgano-alcalinsLes dérivés sodés se préparent généralement par action du sodium sur les organomercuriques: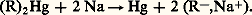 Ces composés sont très oxydables et s’hydratent instantanément en soude et en hydrocarbure. Ils se comportent comme l’anion R- et attaquent en particulier les éthers halohydriques par un processus S2:
Ces composés sont très oxydables et s’hydratent instantanément en soude et en hydrocarbure. Ils se comportent comme l’anion R- et attaquent en particulier les éthers halohydriques par un processus S2: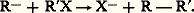 Les organolithiens résultent de l’action du métal sur un dérivé chloré:
Les organolithiens résultent de l’action du métal sur un dérivé chloré: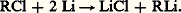 Leur réactivité est intermédiaire entre celle des magnésiens et celle des dérivés des sodés; dans leur action sur les cétones, ils conduisent à des alcoolates avec des rendements supérieurs à ceux obtenus à partir des organomagnésiens; on évite partiellement l’addition -1,4, la réduction, l’énolisation.Groupe IILes organocadmiens et les organozinciques solvatés se préparent à partir des magnésiens par action des halogénures des métaux respectifs: ils constituent ce que l’on appelle parfois des magnésiens atténués; en particulier, dans l’action des chlorures d’acides, la condensation se limite plus facilement à la formation de cétones:
Leur réactivité est intermédiaire entre celle des magnésiens et celle des dérivés des sodés; dans leur action sur les cétones, ils conduisent à des alcoolates avec des rendements supérieurs à ceux obtenus à partir des organomagnésiens; on évite partiellement l’addition -1,4, la réduction, l’énolisation.Groupe IILes organocadmiens et les organozinciques solvatés se préparent à partir des magnésiens par action des halogénures des métaux respectifs: ils constituent ce que l’on appelle parfois des magnésiens atténués; en particulier, dans l’action des chlorures d’acides, la condensation se limite plus facilement à la formation de cétones: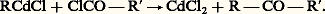 Les zinciques symétriques (R)2Zn se préparent par l’action du métal sur les iodures:
Les zinciques symétriques (R)2Zn se préparent par l’action du métal sur les iodures: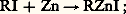 à la distillation R 漣 Zn 漣 R est volatil:
à la distillation R 漣 Zn 漣 R est volatil: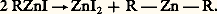 Ces zinciques symétriques non solvatés sont au moins aussi actifs que les magnésiens.Les organomercuriques résultent de l’action de HgCl2 sur un excès d’organomagnésien; ils ne sont pas solvatés et peu réactifs; l’hydrolyse est difficile, surtout pour Hg(C6H5)2.Groupe IIILes organoaluminiques saturés prennent naissance dans l’action, en présence de AlCl3, de l’aluminium sur un bromure sans solvant:
Ces zinciques symétriques non solvatés sont au moins aussi actifs que les magnésiens.Les organomercuriques résultent de l’action de HgCl2 sur un excès d’organomagnésien; ils ne sont pas solvatés et peu réactifs; l’hydrolyse est difficile, surtout pour Hg(C6H5)2.Groupe IIILes organoaluminiques saturés prennent naissance dans l’action, en présence de AlCl3, de l’aluminium sur un bromure sans solvant: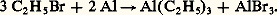 Non solvatés, ce sont des catalyseurs puissants de la polymérisation cationique des alcènes (procédé Natta). L’éther les solvate énergiquement, mais ces solutions ne présentent guère d’intérêt en synthèse.En revanche, les aluminiques 見-non saturés prennent naissance, à partir des bromures correspondants et de l’aluminium, dans les conditions de la réaction de Grignard. Ces aluminiques solvatés, sans action sur un excès d’halogénure, se forment avec d’excellents rendements et se condensent avec les cétones, généralement avec transposition (réaction 10).Groupe IVLes organostanniques , symétriques ou mixtes, résultent de l’action de SnCl4 sur les organomagnésiens. Ils sont relativement peu actifs.Les organoplombiques se forment, en particulier, dans l’action du chlorure plombeux PbCl2 sur les organomagnésiens:
Non solvatés, ce sont des catalyseurs puissants de la polymérisation cationique des alcènes (procédé Natta). L’éther les solvate énergiquement, mais ces solutions ne présentent guère d’intérêt en synthèse.En revanche, les aluminiques 見-non saturés prennent naissance, à partir des bromures correspondants et de l’aluminium, dans les conditions de la réaction de Grignard. Ces aluminiques solvatés, sans action sur un excès d’halogénure, se forment avec d’excellents rendements et se condensent avec les cétones, généralement avec transposition (réaction 10).Groupe IVLes organostanniques , symétriques ou mixtes, résultent de l’action de SnCl4 sur les organomagnésiens. Ils sont relativement peu actifs.Les organoplombiques se forment, en particulier, dans l’action du chlorure plombeux PbCl2 sur les organomagnésiens: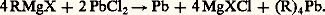 Dérivés métalliques des acétyléniquesBien qu’ils soient un peu moins réactifs, les dérivés R 漣 C 令 C 漣 Na, R 漣 C 令 C 漣 MgX se comportent, en gros, comme les organométalliques saturés.Les dérivés cuivreux et argentiques R 漣 C 令 C 漣 Cu, R 漣 C 令 C 漣 Ag prennent naissance dans l’action sur l’hydrocarbure du chlorure cuivreux ou du nitrate d’argent ammoniacal. Ils sont très peu réactifs; on peut cependant mentionner l’action des halogènes:
Dérivés métalliques des acétyléniquesBien qu’ils soient un peu moins réactifs, les dérivés R 漣 C 令 C 漣 Na, R 漣 C 令 C 漣 MgX se comportent, en gros, comme les organométalliques saturés.Les dérivés cuivreux et argentiques R 漣 C 令 C 漣 Cu, R 漣 C 令 C 漣 Ag prennent naissance dans l’action sur l’hydrocarbure du chlorure cuivreux ou du nitrate d’argent ammoniacal. Ils sont très peu réactifs; on peut cependant mentionner l’action des halogènes: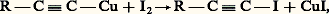 la condensation très curieuse:
la condensation très curieuse: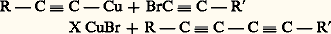 et l’oxydation duplicative:
et l’oxydation duplicative: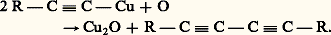 Dérivés dimétalliquesLes dimagnésiens sont assez rares; on peut néanmoins obtenir avec des rendements acceptables ceux qui dérivent des dihalogénures éloignés:
Dérivés dimétalliquesLes dimagnésiens sont assez rares; on peut néanmoins obtenir avec des rendements acceptables ceux qui dérivent des dihalogénures éloignés: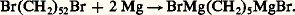 On connaît également le dimagnésien de l’acétylène BrMgC 令 CMgBr.Organométalliques fonctionnelsLa plupart des fonctions agissant énergiquement sur les organomagnésiens, celles qui sont compatibles avec l’existence de la fonction organométallique sont assez rares; on peut cependant signaler la formation d’un organomagnésien à partir d’un halogénure éther-oxyde à fonctions éloignées, par exemple Br(CH2)4OCH3. On a réussi à isoler les organozinciques dérivés des esters 見-halogénés, mais on peut hésiter entre deux structures (réaction 11). Ces organométalliques sont responsables de la réaction de Reformatsky (réaction 12).Enfin, à très basse température et dans des solvants appropriés, prennent naissance, par échange fonctionnel, des organomagnésiens portant des halogènes ou des groupes éthoxy sur le carbone métallé: CHCl2MgCl, par exemple.Il résulte de cet exposé que les organométalliques, les organomagnésiens en particulier, donnent accès à la quasi-totalité des fonctions organiques. Plusieurs de leurs réactions se traduisent par des soudures carbone-carbone, c’est-à-dire qu’elles sont de nature proprement synthétique.Toutefois, ces transformations ont rarement des rendements quantitatifs; elles exigent l’emploi de solvants coûteux, volatils et inflammables, dangereux lorsqu’on opère à grande échelle. C’est la raison pour laquelle, en dehors de la préparation de produits précieux (parfums, médicaments), elles ne sont qu’exceptionnellement employées dans l’industrie.
On connaît également le dimagnésien de l’acétylène BrMgC 令 CMgBr.Organométalliques fonctionnelsLa plupart des fonctions agissant énergiquement sur les organomagnésiens, celles qui sont compatibles avec l’existence de la fonction organométallique sont assez rares; on peut cependant signaler la formation d’un organomagnésien à partir d’un halogénure éther-oxyde à fonctions éloignées, par exemple Br(CH2)4OCH3. On a réussi à isoler les organozinciques dérivés des esters 見-halogénés, mais on peut hésiter entre deux structures (réaction 11). Ces organométalliques sont responsables de la réaction de Reformatsky (réaction 12).Enfin, à très basse température et dans des solvants appropriés, prennent naissance, par échange fonctionnel, des organomagnésiens portant des halogènes ou des groupes éthoxy sur le carbone métallé: CHCl2MgCl, par exemple.Il résulte de cet exposé que les organométalliques, les organomagnésiens en particulier, donnent accès à la quasi-totalité des fonctions organiques. Plusieurs de leurs réactions se traduisent par des soudures carbone-carbone, c’est-à-dire qu’elles sont de nature proprement synthétique.Toutefois, ces transformations ont rarement des rendements quantitatifs; elles exigent l’emploi de solvants coûteux, volatils et inflammables, dangereux lorsqu’on opère à grande échelle. C’est la raison pour laquelle, en dehors de la préparation de produits précieux (parfums, médicaments), elles ne sont qu’exceptionnellement employées dans l’industrie.
Encyclopédie Universelle. 2012.
